Nghiên cứu Khoa học
Nghiên cứu tổng hợp chất kích thích sinh trưởng phenoxy axetic axit và đánh giá hoạt tính sinh học trên cây hoa cúc cn20 trong phòng thí nghiệm
STUDY ON THE SYNTHESIS OF PHENOXY ACETIC ACID-USED AS PLANT GROWTH STIMULANT AND THEIR EVALUATION ON CHRYSANTHEMUM CN20 IN THE LABORATORY
Đinh Văn Kha1, Dương Thị Hằng1, Đồng Thị Hằng1, Lê Sĩ Dũng2
1Viện Hóa học Công nghiệp Việt Nam, 2Viện Di truyền Nông Nghiệp
Tóm tắt
Phenoxy axetic axit (PAA) là chất kích thích sinh trưởng thực vật thuộc nhóm aryloxiaxetic axit, có hoạt tính cao, thân thiện với môi trường và đang được quan tâm nghiên cứu ứng dụng trong thực tế. Bài báo này nêu các kết quả tổng hợp PAA và thử nghiệm hoạt tính sinh học của PAA trên hoa cúc CN20 trong phòng thí nghiệm. Khi sử dụng PAA ở nồng độ 0,2mg/l trong nuôi cấy mô ở hai giai đoạn: nhân nhanh và ra rễ, kết quả cho thấy PAA có hoạt tính sinh học cao hơn so với đối chứng α-naphtalenaxetic axit (α-NAA) ở cả hai giai đoạn.
Abstract
Phenoxy acetic acid (PAA), which belongs to the family of aryloxyacetic acids, is an eco-friendly plant growth stimulant with outstanding activity. This article presents the synthesis and the test of biological activity of PAA on Chrysanthemum plants CN20. The results show that in the role of plant growth stimulant, PAA at a concentration of 2mg/l represents higher effect than the controlled α-naphthaleneacetic acid (α-NAA) during the tissue culture in both stages: multiplication and root formation.
I. MỞ ĐẦU
Phenoxy axetic axit (PAA) là chất kích thích sinh trưởng (KTST) thuộc họ aryloxi axetic axit, có nhiều đặc tính ưu việt như liều lượng sử dụng nhỏ, hiệu quả tác dụng cao và khá thân thiện với môi trường [1]. PAA được tổng hợp theo nhiều phương pháp khác nhau, trong đó phương pháp ngưng tụ phenol với axit monocloaxetic axit trong môi trường kiềm được quan tâm vì hiệu suất cao và dễ thực hiện [2]. Hoạt tính sinh học của PAA tổng hợp được thử nghiệm thực tế trên cây hoa cúc CN20 và có so sánh đối chứng với α-NAA (chất KTST thường được sử dụng trong nuôi cấy mô cúc CN20) [3].
CN20 có đặc tính ổn định, sinh trưởng và phát triển tốt, đây là giống chủ lực được bộ Nông nghiệp và phát triển nông thôn công nhận là giống chính thức tháng 11/2007 [4].
II. VẬT LIỆU VÀ NỘI DUNG NGHIÊN CỨU
1. Đối tượng nghiên cứu
Đối tượng nghiên cứu là chất KTST: Phenoxy axetic axit (PAA)
| Khối lượng phân tử: 152
Nhiệt độ nóng chảy: 99oC Tan trong nước, cồn, ete… |
Đối tượng ứng dụng: Giống hoa cúc CN20 (Viện Di truyền Nông nghiệp).
Chất đối chứng: α-Naphtylaxetic axit (α-NAA).
2. Nội dung nghiên cứu
2.1. Tổng hợp chất KTST PAA trong phòng thí nghiệm
PAA được tổng hợp theo phương pháp ngưng tụ phenol với axit monoclo axetic trong môi trường kiềm với các điều kiện như sau:
- Tỷ lệ mol phản ứng giữa phenol, axit monocloaxetic là 1:1,2;
- Thời gian phản ứng là 90 phút;
- Nhiệt độ phản ứng là 85-90oC.
Sau quá trình tổng hợp, PAA được tinh chế và kết tinh trong nước lạnh. Sản phẩm thu được dạng tinh thể hình kim, màu trắng hồng. Hiệu suất tổng hợp cả quá trình trên 80%.
2.2. Đánh giá khả năng KTST của PAA trên CN20 trong nuôi cấy mô
Thí nghiệm 1: Ảnh hưởng của PAA đến khả năng tái sinh chồi của giống cúc CN20 so với đối chứng là α-NAA ở giai đoạn nhân nhanh. Có 4 công thức thí nghiệm (CTTN):
| CT1: MT + 0,2 mg/l α-NAA (đ/c) |
CT3: MT + 0,2 mg/l PAA |
| CT2: MT + 0,1 mg/l PAA |
CT4: MT + 0,3 mg/l PAA |
MT (MT nền): MS + 10% nước dừa + 20g/l đường + 7 g/l agar + 0,7 mg/l BAP
Thí nghiệm 2:Ảnh hưởng của PAA đến khả năng ra rễ của giống cúc CN20 so với đối chứng là α-NAA ở giai đoạn ra rễ. Có 4 CTTN:
| CT1: MT + 0,2 mg/l α-NAA (Đ/C) |
CT3: MT + 0,2 mg/l PAA |
| CT2: MT + 0,1 mg/l PAA |
CT4: MT + 0,3 mg/l PAA |
MT (MT nền): MS + 20g/l đường + 7 g/l agar + 0,05 mg/l IBA
MS: Môi trường nuôi cấy mô được Murashige T & Skoog F phát minh năm 1962.
BAP: ((6-bezylamino)-9-(2-tetrahydropyranyl)-9H-purine), IBA: Indol butyric axit.
III. KẾT QUẢ VÀ THẢO LUẬN
3.1. Xác định cấu trúc PAA tổng hợp
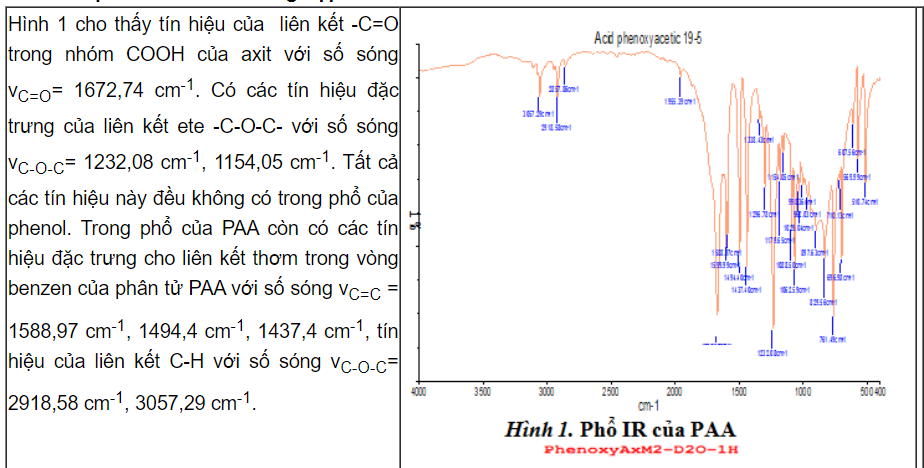



Như vậy tất cả các dữ kiện trên phổ hồng ngoại, phổ cộng hưởng từ hạt nhân 1H, 13C đã khẳng định chính xác cấu tạo của PAA đã tổng hợp được [5]. Kết quả phân tích HPLC cho thấy, PAA sau quá trình tổng hợp và tinh chế cho hàm lượng 98,37%.
3.2. Thử nghiệm hoạt tính sinh học của PAA trên cây hoa cúc CN20
Thí nghiệm 1: α-NAA được bổ sung nồng độ 0,2mg/l làm đối chứng và chất kích thích sinh trưởng PAA ở các nồng độ khác nhau (0,1; 0,2 và 0,3mg/l) để so sánh và đánh giá. Sau 1 tuần cấy chuyển, tiến hành quan sát và đo đếm trực tiếp số chồi phát sinh thêm (1 tuần đếm 1 lần); mỗi lần theo dõi 30 bình. Các kết quả theo dõi được trình bày ở bảng 1 và hình 5.
Bảng 1. Ảnh hưởng của nồng độ PAA đến khả năng tái sinh chồi của cúc CN20
|
CTTN |
Số chồi cấy/bình |
Số chồi phát sinh/bình |
|||||
|
Sau 1 tuần |
Hệ số nhân |
Sau 2 tuần |
Hệ số nhân |
Sau 3 tuần |
Hệ số nhân |
||
|
CT1 (đ/c) |
12 |
15,4 |
1,28 |
23,5 |
1,96 |
30,7 |
2,56 |
|
CT2 |
12 |
16,2 |
1,35 |
24,1 |
2,0 |
31,5 |
2,63 |
|
CT3 |
12 |
18,0 |
1,50 |
28,3 |
2,36 |
35,8 |
2,98 |
|
CT4 |
12 |
17,6 |
1,46 |
26,4 |
2,20 |
32,4 |
2,70 |
|
CV% |
2,3 |
|
1,4 |
|
3,5 |
|
|
|
LSD0,05 |
0,05 |
|
0,13 |
|
0,32 |
|
|
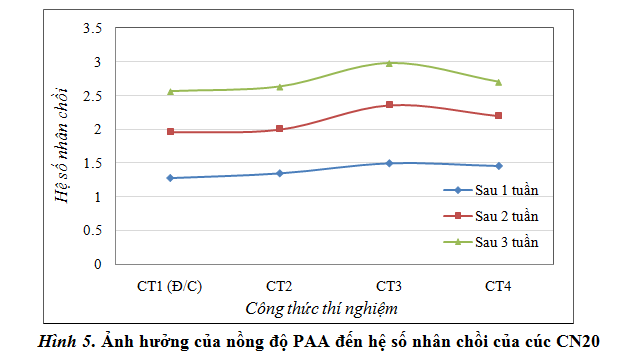
Từ kết quả bảng 1 nhận thấy, các chất KTST ở các nồng độ khác nhau đều làm tăng khả năng phát sinh chồi của giống cúc CN20. Tuy nhiên ở CT1 có bổ sung 0,2mg/l α-NAA lại cho kết quả thấp nhất so với các công thức có bổ sung PAA, mặc dù đây là môi trường chuẩn đã được nghiên cứu và công nhận, quan sát trực tiếp cũng nhận thấy chồi mới phát sinh từ các công thức có bổ sung PAA đều mập hơn và xanh hơn so với công thức đối chứng.
Đối với PAA, trong tất cả các CTTN thì CT3 (bổ sung 0,2 mg/l PAA) là công thức cho kết quả tốt nhất: hệ số nhân chồi qua 1 tuần, 2 tuần, 3 tuần cấy chuyển lần lượt là 1,5; 2,36; 2,98 cao hơn so với công thức đối chứng lần lượt là 0,22; 0,4 và 0,42.
Như vậy có thể kết luận khả năng phát sinh chồi khi bổ sung PAA cao hơn so với α-NAA, như vậy cũng chứng tỏ hoạt tính KTST của PAA trên giống cúc CN20 cao hơn α-NAA. Nồng độ chất PAA thích hợp nhất cho sự phát sinh chồi trên cúc CN20 ở giai đoạn nhân nhanh là 0,2mg/l.

Thí nghiệm 2: Tiến hành nghiên cứu thử nghiệm hoạt tính KTST trong giai đoạn tạo rễ của giống cúc CN20 khi được bổ sung PAA so với đối chứng là α-NAA (chất thường được sử dụng trong nuôi cấy mô giống cúc CN20 ở giai đoạn tạo rễ).Quá trình theo dõi được thực hiện sau khi đưa vào môi trường tạo rễ 1 tuần và 2 tuần nuôi cấy. Kết quả theo dõi ở bảng 2 và biểu đồ hình 7 cho thấy các công thức khác nhau cho các chỉ tiêu theo dõi khác nhau rõ rệt. Sau 1 tuần nuôi cấy, cây phát sinh rễ ít, số rễ/cây chỉ từ 1-3 rễ nhưng sau 2 tuần thì số rễ tăng lên 4-5 rễ; rễ cũng dài ra từ 0,1-0,4 cm và tỷ lệ ra rễ cũng tăng lên sau 2 tuần nuôi cấy (30% – 98%). Các kết quả theo dõi được thể hiện qua bảng 2 và hình 7.
Bảng 2. Ảnh hưởng của PAA đến khả năng ra rễ của giống cúc CN20
|
CT TN
|
1 tuần sau nuôi cấy |
2 tuần sau nuôi cấy |
||||||
|
Chiều dài TB rễ (cm) |
Tỷ lệ ra rễ (%) |
Số rễ/cây |
Hình thái rễ |
Chiều dài TB rễ (cm) |
Tỷ lệ ra rễ (%) |
Số rễ/cây |
Hình thái rễ |
|
|
CT1 |
0,15 |
35,5 |
1,5 |
Rễ nhỏ, ngắn, ít lông hút, màu trắng sữa |
0,37 |
80,3 |
3,5 |
Rễ nhỏ, có lông hút, màu trắng sữa |
|
CT2 |
0,11 |
30,3 |
2,1 |
Rễ nhỏ, ngắn, ít lông hút, màu trắng sữa |
0,35 |
75,1 |
3,2 |
Rễ nhỏ, ngắn, ít lông hút, màu trắng sữa |
|
CT3 |
0,19 |
43,2 |
3,0 |
Rễ nhỏ, có lông hút, màu trắng |
0,42 |
98,5 |
4,5 |
Rễ mập hơn, có lông hút, màu trắng |
|
CT4 |
0,16 |
37,4 |
2,6 |
Rễ nhỏ, ít lông hút, màu trắng vàng |
0,30 |
87,6 |
4,2 |
Rễ mập, ít lông hút, màu trắng vàng |
|
CV% |
4,2 |
|
CV% |
3,2 |
|
|||
|
LSD0,05 |
0,25 |
|
LSD0,05 |
0,21 |
|
|||
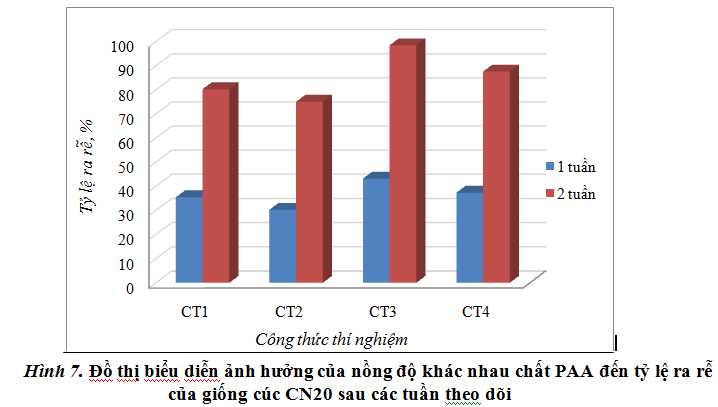
Trong các công thức có bổ sung chất PAA cho thấy, khi sử dụng ở nồng độ khác nhau thì các chỉ tiêu theo dõi cũng chênh lệch rõ rệt so với đối chứng. Khi bổ sung 0,1mg/l PAA vào môi trường ra rễ, nhận thấy chiều dài rễ, tỷ lệ ra rễ đều thấp hơn so với đối chứng lần lượt là 0,04cm; 5,2% (sau 1 tuần nuôi cấy) và 0,02cm; 5,4%. Nguyên nhân là do nồng độ sử dụng quá thấp nên khả năng kích thích tạo rễ kém hơn. Khi bổ sung 0,3mg/l PAA, nhận thấy các chỉ tiêu theo dõi đều cao hơn đối chứng, tỷ lệ ra rễ cao hơn từ 1,9% (sau 1 tuần) đến 7,3% (sau 2 tuần). Khi quan sát hình thái rễ, ở các CTTN sử dụng PAA đều cho hình thái rễ tốt hơn so với đối chứng. Điều này chứng tỏ, chất KTST PAA không những làm tăng khả năng ra rễ của giống cúc CN20 mà còn cải thiện được đặc tính hình thái của rễ trong giai đoạn tạo rễ. Từ đó tăng tỷ lệ sống cho quá trình ra cây ngoài vườn ươm sau này.
Ở CT3, sử dụng 0,2 mg/l PAA (cùng nồng độ với đối chứng) nhận thấy các chỉ tiêu theo dõi đều cao hơn hẳn so với đối chứng. Tỷ lệ ra rễ cao hơn từ 7,7% (sau 1 tuần nuôi cấy) đến 18,2% (sau 2 tuần nuôi cấy). Số rễ/cây, chiều dài rễ cũng như các đặc điểm hình thái rễ ở công thức này cũng ưu thế hơn hẳn so với đối chứng. Điều này chứng tỏ hoạt tính sinh học của chất PAA cao hơn so với α-NAA trong giai đoạn ra rễ của cúc CN20.
Như vậy, trong các CTTN bổ sung PAA, công thức cho khả năng ra rễ tốt nhất là CT3 (nồng độ 0,2 mg/l PAA). Đây là nồng độ phù hợp nhất để bổ sung vào môi trường ra rễ cho giống cúc CN20.

IV. KẾT LUẬN
PAA được tổng hợp theo phương pháp ngưng tụ phenol với monocloaxetic trong môi trường kiềm có độ tính khiết cao, hiệu suất đạt trên 80%. Qua quá trình thử nghiệm hoạt tính sinh học cho thấy, PAA có tác dụng kích thích sinh trưởng đối với cây hoa cúc CN20 trong nuôi cấy mô và có hiệu quả cao hơn so với chất KTST thông dụng α-NAA ở cùng nồng độ: với cùng liều lượng phun là 0,2 mg/l, CN20 dùng PAA phát sinh chồi đều, mập và xanh hơn so trường hợp dùng α-NAA ở giai đoạn nhân nhanh; CN20 dùng PAA có tỷ lệ ra rễ, số rễ/cây, chiều dài rễ và hình thái rễ cũng ưu thế hơn so với CN20 dùng α-NAA ở giai đoạn ra rễ.
LỜI CẢM ƠN
Trên đây là một phần kết quả nghiên cứu của đề tài “Nghiên cứu tổng hợp và thử nghiệm 02 chất kích thích sinh trưởng thuộc nhóm aryloxiaxetic axit có hoạt tính cao, thân thiện với môi trường”. Nhóm tác giả chân thành cảm ơn Tập đoàn Hóa chất Việt Nam đã cấp kinh phí và tạo mọi điều kiện để chúng tôi thực hiện thành công công trình nghiên cứu này.
TÀI LIỆU THAM KHẢO
- Anju Srivastav, Subha R. Saxena, Sunil Mishra, Y.Singh, 2012, Molecular Structure, Experimental and Theoretical Spectroscopic studies and quantum chemical calculation of phenoxyacetic acid and its p-chloro derivative, Oriental Journal of Chemistry, Vol 28, No. (3), p1517-1529;
- Mohammad F. M. Al-Dulaymmi, 2012, Preparation & formulation, of two active ingredients as a plant growth regulators and their evaluation on tomato, Department of chemistry, Collage of Science, University of Anbar, Anbar-Iraq;
- Nguyễn Thị Kim Lý, 2004, Nghiên cứu quy trình nhân nhanh giống cúc CN20, Tạp chí Nông nghiệp và phát triển nông thôn số 12;
- Lê Sỹ Dũng, 2007, Hoàn thiện quy trình công nghệ nhân giống, sản xuất hoa cúc CN1, CN 20 chất lượng cao phục vụ nội tiêu và xuất khẩu, Viện Khoa học Nông nghiệp Việt Nam.
- M. Samsonowicz, E. Regulska, and W. lewandowski, 2012, Spectroscopic (FT-IR, Raman, NMR) and DFT Quantum Chemical Studies on Phenoxyacetic acid and Its Sodium Salt, Journal of Spectroscopy, Vol 27, Issue 5-6, p307-313;


